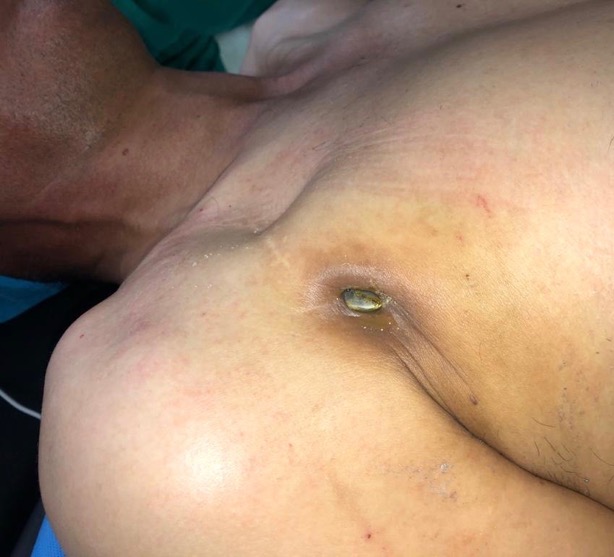
Figure 1 : Extériorisation du boitier du pacemaker double chambre avec écoulement purulent
Auteurs :
Meryem BENNANI, Jaouad NGUADI, Abdelillah BEN EL MEKKI, Jamal KHEYI, Hicham BOUZELMAT, Ali CHAIB
Service de Rythmologie, Centre de Cardiologie, HMIMV-RABAT
Découvrez l’histoire clinique assez singulière de ce patient de 67 ans, porteur d’un PM double chambre implanté en 2011 pour BAV complet symptomatique, vu en consultation en juillet 2020 pour prise en charge d’une extériorisation du boitier du PM évoluant depuis 03 mois dans un contexte d’apyrexie.
Homme de 67 ans, diabète de type 2 depuis 04 ans sous ADO
Histoire Clinique : Patient vu en consultation de rythmologie en juillet 2020 pour extériorisation du boitier avec écoulement jaunâtre (Figure1) sans altération de l’état général ni fièvre évoluant depuis 3 mois (le patient est resté confiné chez lui en raison de la pandémie COVID-19). L’interrogatoire ne relève ni soins dentaires, ni transfusion récente, ni prise médicamenteuse ou drogues intra veineuse.
Clinique : TA : 126/80 mmHg, FC à 60 bpm, Température : 37°C. Pas de souffle à l’auscultation cardiovasculaire. Absence de point d’appel clinique infectieux.
ECG (Figure 2) : ECG (Figure 2) inscrit un rythme électro entrainé à 60 bpm avec FA permanente. (Passage en arythmie depuis 01 an et commutation de mode en VVI)
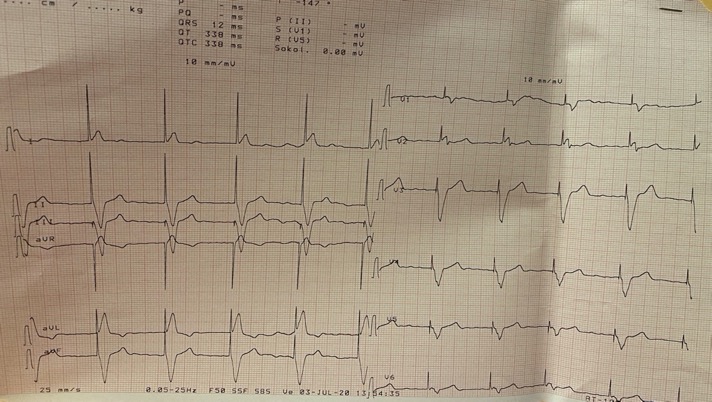
Figure 2 : ECG de surface
Question 1: quel diagnostic évoquez-vous ? Quels bilans complémentaires demandez-vous ?

Pour notre patient :
• Il existe un exsudat purulent du site d’incision avec déhiscence de la plaie, une érosion à travers la peau ainsi qu’une exposition du boitier.
• Le bilan biologique est négatif : GB à 5700 éléments/mm-3 , CRP à 0,9 mg/L et Procalcitonine à 0,01 microg/L. Les écouvillons des sécrétions issus de la plaie et les hémocultures restent stériles.
• A l’échocardiographie transthoracique, il n’exite pas d’éléments mobiles ou de végétations sur le trajet des sondes de pacemakers en place, ni au niveau de la valve tricuspide (données confirmées par l’ETO). L’IT est minime sans HTAP (Figures3 et 4).
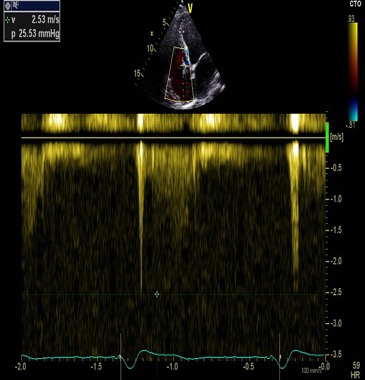
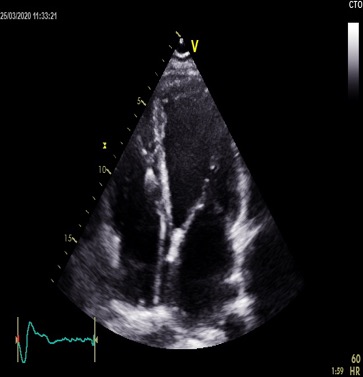
Figure 3: ETT : Incidence apicale 4 cavités visualisant les sondes de PM au niveau des cavités cardiaques droites, sans éléments mobiles
Figure 4 : Flux d’IT en Doppler continu, sans HTAP.
Il s’agit donc d’une Infection de la loge du pacemaker non compliquée.
Question 2 - Au vu de la situation clinique, quelles sont les indications et les modalités de prise en charge ?

Tableau 1: Récapitulatif des recommandations de l’ESC 2015 (1)
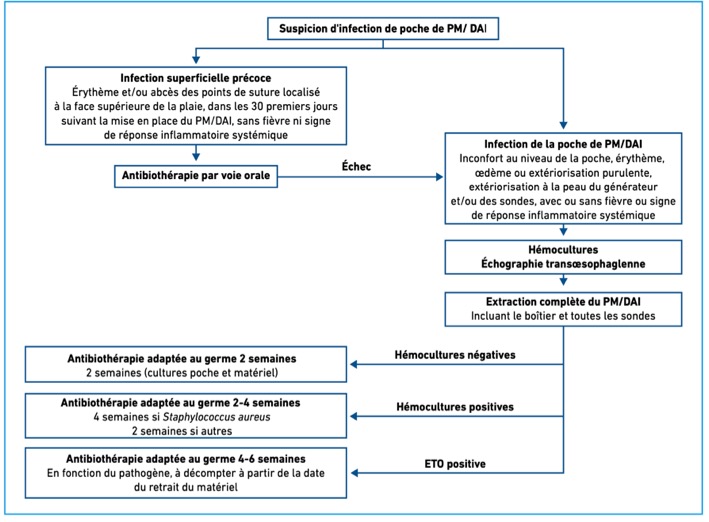
Tableau 2 : Conduite à tenir en cas de suspicion d’infection « locale »
Pour notre patient, l’implantation du PM étant ancienne (datant de 9 ans), une extraction de matériel par laser EXCIMER (Photos et vidéos ci-dessous) a été réalisée dans notre formation avec implantation d’une sonde d’électrostimulation systolique provisoire ipsilatérale jugulaire (patient dépendant d’une stimulation définitive).
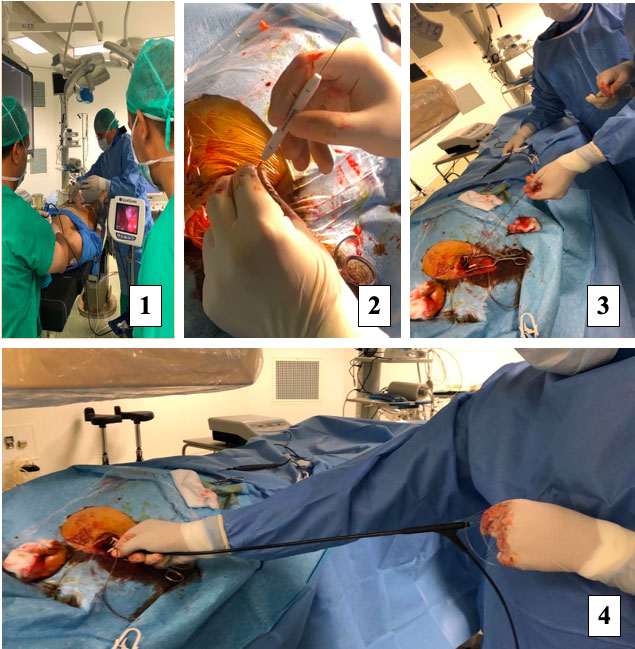
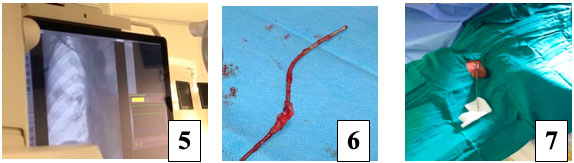
6. Sonde ventriculaire après extraction. 7. Ponction de la veine jugulaire ipsilatérale et mise en place d’une sonde stimulation connectée à un boitier externe.
Question 3: Quel est le timing pour la réimplantation d’un nouveau PM?
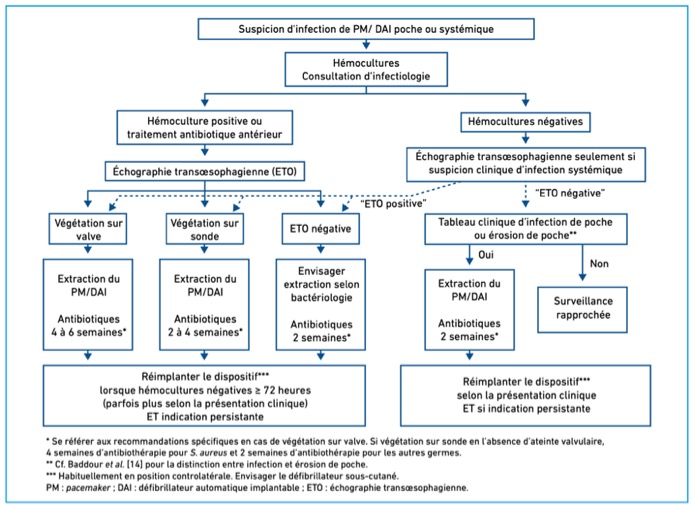
Tableau 3 : Conduite à Tenir concernant la réimplantation en cas d’infection de la loge du PM et/ou endocardite infectieuse sur PM (3)
Conclusion :
L’infection de DEIC est une entité distincte.
Il existe plusieurs formes cliniques allant de la simple infection de la loge à l’endocardite infectieuse.
La négativité des bilans biologiques et échocardiographiques dans ce contexte ne dispense pas de l’extraction ni de la nécessité d’une antibiothérapie rigoureuse.
L’extraction par laser est une option thérapeutique prometteuse dans les extractions de sondes de DEIC, évitant dans beaucoup de situations le recours à la chirurgie.
Références bibliographiques :
(1)Habib G, Lancellotti P, Antunes MJ, et al. ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2015: 36:3075–128.
(2)Sandoe JAT, Barlow G, Chambers JB, et al. Guidelines for the diagnosis, prevention and management of implantable cardiac electronic device infection. Report of a joint Working Party project on behalf of the British Society for Antimicrobial Chemotherapy (BSAC, host organization), British Heart Rh. J Antimicrob Chemother 2015 F70(2):325–59.
(3)Baddour LM, Epstein AE, Erickson CC et al. Update on cardiovascular implantable electronic device infections and their management. A scientific statement from the AHA. Circulation, 2010;121: 458-477.







